臨床試驗機(jī)構(gòu)辦事指南
機(jī)構(gòu)辦聯(lián)系方式0871-65610072
辦公地址
1、臨床試驗機(jī)構(gòu)辦公室(以下簡稱機(jī)構(gòu)辦)地址: 云南省精神病醫(yī)院5號樓 1 樓臨床試驗機(jī)構(gòu)辦公室
2、機(jī)構(gòu)GCP中心藥房地址: 云南省精神病醫(yī)院5號樓 1 樓臨床試驗機(jī)構(gòu)GCP中心藥房
3、機(jī)構(gòu)資料室地址: 云南省精神病醫(yī)院5號樓 1 樓臨床試驗機(jī)構(gòu)資料室
初次溝通與 SSU(臨床試驗啟動前的準(zhǔn)備階段) 流程
1、申辦方/CRO(合同研究組織) 應(yīng)首先聯(lián)系機(jī)構(gòu)辦主任溝通承接意向:如先與合作 PI(主要研究者) 聯(lián)系,應(yīng)盡快與機(jī)構(gòu)辦主任聯(lián)系。
2、申辦方/CRO 發(fā)送項目簡介(方案摘要等)至郵箱:[email protected]。
3、機(jī)構(gòu)辦主任根據(jù)方案及適應(yīng)癥等初步評估是否有承接能力,必要時匯報機(jī)構(gòu)主任評估。
4、雙方互有合作意向后,可組織安排雙方或多方溝通和接洽,溝通和接洽方式包括電話、郵件和現(xiàn)場交流。
5、溝通和接洽內(nèi)容包括:了解申辦方/CRO 項目合作需求、完成申辦方/CRO 項目調(diào)研問卷、介紹研究中心工作流程和對接人、提供研究中心實施基礎(chǔ)條件、可
推薦項目承接科室和 PI。
6、溝通結(jié)果反饋:申辦方/CRO 向研究中心反饋調(diào)研結(jié)果,雙方確定合作意向后,申辦方/CRO 根據(jù)研究中心立項要求開始準(zhǔn)備立項資料。
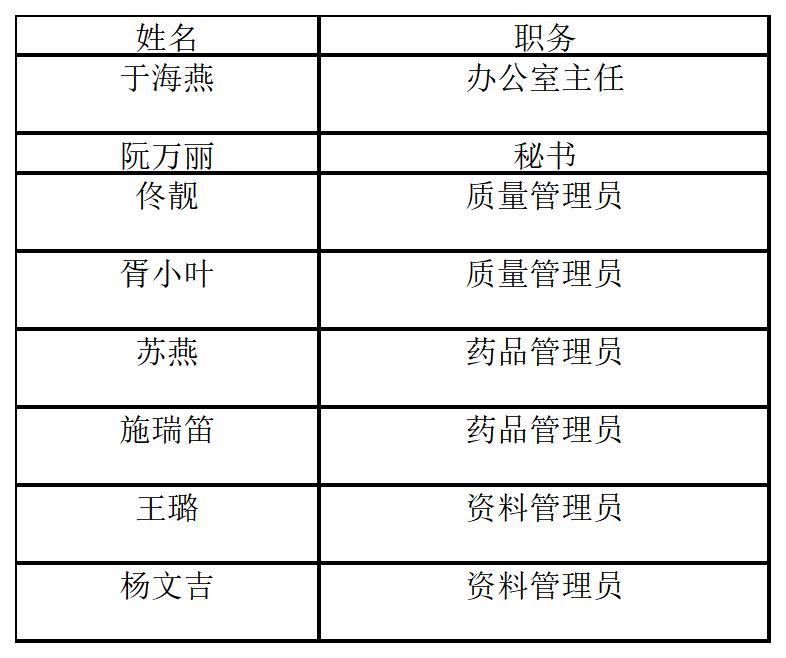
聯(lián)系人:阮萬麗
立項流程
1、立項流程
1. 確立合作意向
申辦者/CRO與機(jī)構(gòu)辦公室或?qū)I(yè)科室負(fù)責(zé)人聯(lián)系臨床試驗項目后,機(jī)構(gòu)辦公室主任與專業(yè)科室負(fù)責(zé)人共同評估是否同意承接該項臨床試驗并告知申辦者/CRO。
2. 提出立項申請
(1) 合作意向確立后,機(jī)構(gòu)辦公室主任與專業(yè)科室負(fù)責(zé)人確定主要研究者。
(2) 機(jī)構(gòu)辦公室主任、主要研究者參加多中心研究者會議,針對臨床試驗方案、知情同意書等進(jìn)行討論。
(3) 主要研究者提出立項申請,并連同相關(guān)資料發(fā)送給機(jī)構(gòu)辦秘書,同時提交已簽名的紙質(zhì)版《臨床試驗立項申請表》。
(4) 機(jī)構(gòu)辦公室秘書登記臨床試驗相關(guān)信息,包括申辦者/CRO、項目名稱、監(jiān)查員姓名及聯(lián)系方式、專業(yè)科室、主要研究者、方案接收時間、方案討論會日期等。
(5) 立項清單如下:
|
序號 |
文件名 |
應(yīng)提供份數(shù) |
備注 |
|
1 |
臨床試驗立項申請?zhí)峤晃募鍐?/span> |
1 |
/ |
|
2 |
臨床試驗立項申請表 |
1 |
原件 |
|
3 |
藥物臨床試驗批件/備案文件(含臨床試驗?zāi)驹S可公示截圖) |
1 |
加蓋申辦者/CRO章 |
|
4 |
臨床試驗方案(注明版本號及日期,含方案認(rèn)可簽署頁) |
1 |
加蓋申辦者/CRO章 |
|
5 |
研究者手冊(注明版本號及日期) |
1 |
加蓋申辦者/CRO章 |
|
6 |
知情同意書(注明版本號及日期) |
1 |
加蓋申辦者/CRO章 |
|
7 |
招募受試者的相關(guān)材料(包括廣告,如有請?zhí)峁?/span> |
1 |
加蓋申辦者/CRO章 |
|
8 |
保險證明 |
1 |
加蓋申辦者/CRO章 |
|
9 |
病例報告表 |
1 |
加蓋申辦者/CRO章 |
|
10 |
受試者日記、受試者信息卡(如有請?zhí)峁?/span> |
1 |
加蓋申辦者/CRO章 |
|
11 |
申辦者及CRO的資質(zhì)證明(營業(yè)執(zhí)照、GMP證書) |
1 |
加蓋申辦者/CRO章 |
|
12 |
項目委托相關(guān)文件(申辦者對CRO委托函、申辦者/CRO對CRA委托函及被委托人培訓(xùn)證書) |
1 |
加蓋申辦者/CRO/SMO章 |
|
14 |
試驗用藥品檢驗合格報告(包括試驗藥、對照藥等) |
1 |
復(fù)印件需加蓋申辦者/CRO章 |
|
15 |
產(chǎn)品說明書(已上市藥物需要) |
1 |
/ |
|
16 |
組長單位及其他中心倫理審查意見 |
1 |
復(fù)印件需加蓋申辦者/CRO章 |
|
17 |
主要研究者及研究者簡歷及資格證書(執(zhí)業(yè)資格證、職稱證、GCP證書) |
1 |
/ |
|
18 |
其它(如有請自行增加) |
1 |
加蓋申辦者/CRO章 |
3. 審核、批準(zhǔn)立項申請
3.1 機(jī)構(gòu)辦公室秘書及其他人員核對申請表中相關(guān)內(nèi)容,并對提交材料進(jìn)行形式審查和科學(xué)性審查。
3.2 機(jī)構(gòu)辦公室主任審核“臨床試驗立項申請表”及試驗相關(guān)材料后,綜合專業(yè)科室意見,根據(jù)科室資質(zhì)、條件、設(shè)施、人員情況、主要研究者臨床試驗項目在研情況等,審批申請項目在本中心專業(yè)科室進(jìn)行臨床試驗,簽名并注明日期。
3.3 機(jī)構(gòu)辦公室秘書及時將立項審查結(jié)果通知申辦方或CRO代表
(1) 不同意立項,可將申辦方和CRO資料退回,申辦方/CRO聲明無需退回的,則由機(jī)構(gòu)辦負(fù)責(zé)銷毀,退回或銷毀需做好相應(yīng)記錄。
(2) 需要補(bǔ)充材料或有問題需要協(xié)商或澄清,機(jī)構(gòu)辦秘書及時通知申辦方補(bǔ)充材料重新遞交,跟進(jìn)至問題解決后立項。
3.4 倫理審查申請
臨床試驗立項申請經(jīng)審核批準(zhǔn)后,主要研究者向倫理審查委員會提交倫理審查申請。
3.5 倫理審查
本中心倫理審查委員會對臨床試驗項目進(jìn)行倫理審查, 并形成書面審查記錄和倫理審查批件。
3.6 簽訂協(xié)議
(1) 與申辦者/CRO簽訂臨床試驗協(xié)議,明確雙方權(quán)利、義務(wù)及責(zé)任分擔(dān)等,項目經(jīng)費應(yīng)納入財務(wù)部門統(tǒng)一管理。
(2) 建立臨床試驗經(jīng)費管理制度,對批準(zhǔn)立項的臨床試驗經(jīng)費進(jìn)行統(tǒng)一管理。經(jīng)費的收取、使用和分配應(yīng)當(dāng)遵循財務(wù)管理制度,專業(yè)科室和個人不得私自收受臨床試驗項目經(jīng)費及相關(guān)設(shè)備。